Caiaimage/Мартін Барро
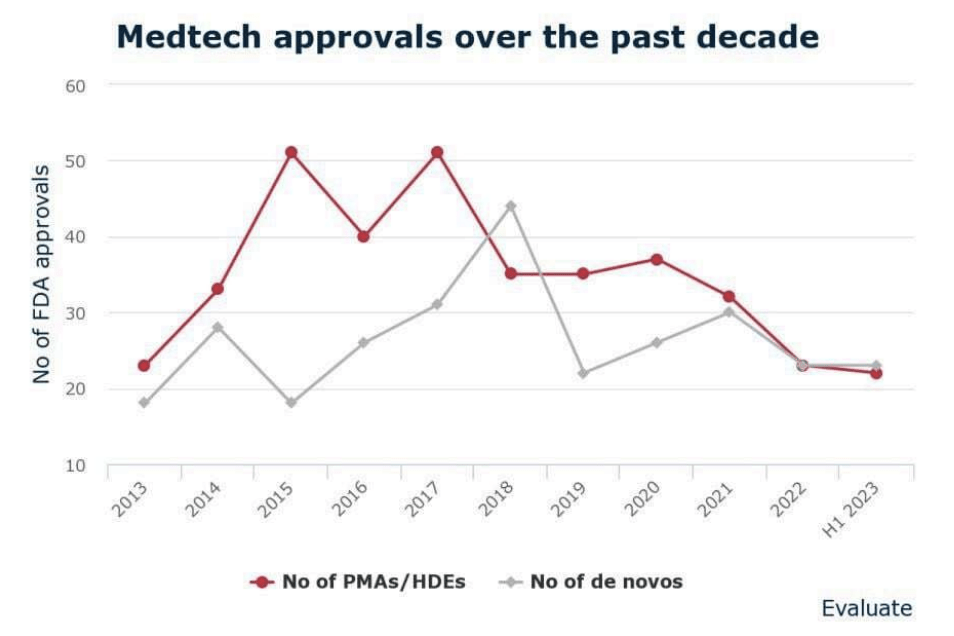
У США може бути отримано найбільшу кількість схвалень на медичні пристрої приблизно за 10 років, враховуючи велику кількість схвалень, наданих FDA США в першій половині 2023 року.
Центр приладів і радіологічного здоров’я агентства у першому півріччі схвалено або дозволено 45 нових пристроїв або продуктів, лише на один менше, ніж за весь 2022 рік.
Однак, згідно з новим звітом Evaluate Vantage, FDA витрачає більше часу на надання дозволів. Було встановлено, що CDRH витратив у середньому ~3 роки, щоб надати 22 дозволи на пристрої високого ризику, що набагато довше порівняно з попередніми роками. Фармацевтична, біотехнологічна та медична аналітична фірма зазначила, що два з цих пристроїв чекали на схвалення більше 10 років.
Evaluate Vantage виявив, що між 2013 і 2022 роками FDA витрачало в середньому 16,4 місяців, щоб надати заявки на схвалення перед продажем (PMA) і заявки на звільнення від медичних пристроїв (MDE). Для заявок, схвалених у першому півріччі 2023 року, ця цифра вдвічі більша.
За словами Evaluate Vantage, велика частина причин поганих результатів медтехнічних схвалень минулого року пов’язана з пандемією COVID-19, через яку FDA перевірило багато заявок на використання пристроїв для отримання дозволу на екстрене використання, а не традиційні шляхи. Багато EUA стосувалися діагностичних пристроїв і апаратів ШВЛ.
У першому півріччі 2023 року чотири діагностичні тести на COVID отримали дозвіл de novo. Троє з QuidelOrtho (QDEL) і один від Cue Health (HLTH).
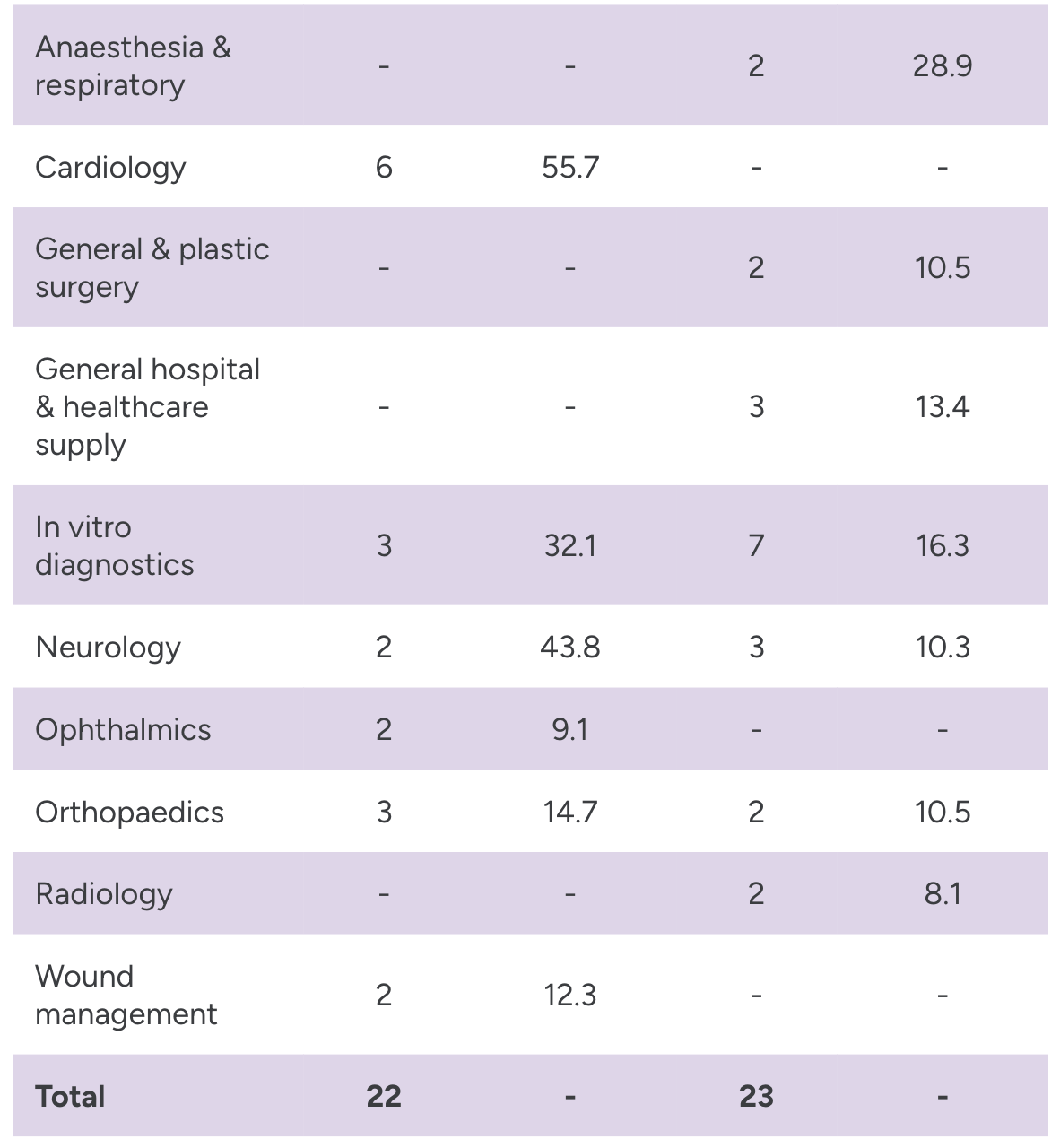
У першій половині року FDA схвалило 22 PMA та HDE, а також 23 заявки de Novo. Діагностика in vitro отримала найбільшу кількість комбінованих схвалень (10), за якою йшла кардіологія (6).
Джерело: Evaluate Medtech і FDA. Примітка. Області з менш ніж двома схваленнями були виключені з діаграми.
як Оцініть перевагу зазначив, що в жовтні 2022 року CDRH запустив свій Програма консультацій щодо повного життєвого циклу продукту (TAP)пілотна програма, призначена для прискорення схвалень шляхом покращення зв’язку між агентством і компаніями.
Станом на 31 липня – п’ять пристроїв зарахований до ТАП. Крім того, починаючи з 1 жовтня, програма буде розширена, щоб включити офіс неврологічних і фізичних медичних пристроїв.
У фінансовому 2023 році програма має намір зареєструвати до 15 пристроїв, обмежених серцево-судинними, у програмі. У 2024 фінансовому році ця кількість збільшиться до 45 і не буде обмежена.
«Програма TAP ще не встигла відчути свій ефект, але вона могла б допомогти агентству швидше переглядати інноваційні пристрої в майбутньому», — написала Елізабет Кернс з Evaluate Vantage.
Вибрані медичні компанії: Medtronic (NYSE:MDT), Boston Scientific (NYSE:BSX), Edwards Lifesciences (NYSE:EW), і Abbott Laboratories (NYSE:ABT).
Більше про medtech
Medtronic: розширення портфоліо продуктів без впливу на зростання дивідендів
Boston Scientific залишається операційно здоровою, але може мати обмежені переваги
Edwards Lifesciences: повільно наближається до своєї внутрішньої цінності